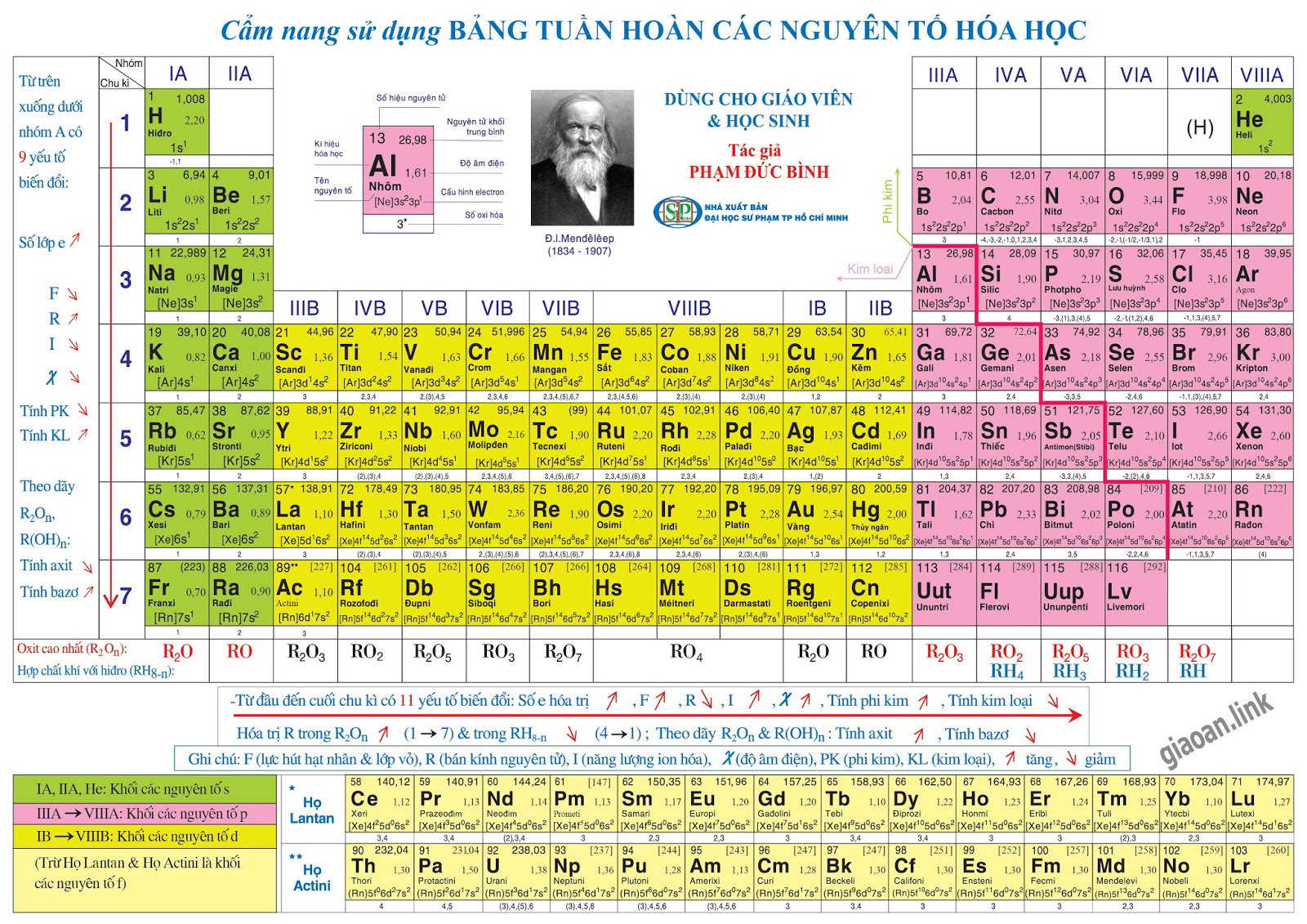
Bảng tuần hoàn các nguyên tố hóa học
Trong nghiên cứu, giảng dạy và học tập môn hóa học thì bảng tuần hoàn (hay hệ thống tuần hoàn) các nguyên tố hóa học là một công cụ rất cần thiết. Có nhiều dạng bảng tuần hoàn khác nhau như bảng tuần hoàn dạng bậc thang, bảng tuần hoàn dạng quạt xòe, bảng tuần hoàn dạng múi nhưng phổ biến nhất là bảng tuần hoàn dạng ô (có hai loại bảng dài và bảng ngắn). Ở bài này chúng ta nghiên cứu bảng tuần hoàn dạng ô dài.
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố trong BTH được xếp theo chiều tăng dần của điện tích hạt nhân (từ trái sang phải, từ trên xuống dưới)
- Các nguyên tố có cùng số lớp e xếp vào cùng một hàng (chu kì).
- Các nguyên tố có cấu hình e tương tự nhau được xếp vào cùng một cột (nhóm).
Cấu tạo bảng tuần hoàn
Ô nguyên tố
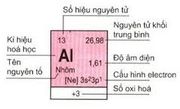
- Mỗi nguyên tố hóa học chiếm một ô trong bảng tuần hoàn được gọi là ô nguyên tố.
- Số thứ tự ô nguyên tố = số hiệu nguyên tử của nguyên tố (= số e = số p = số đơn vị điện tích hạt nhân).
Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp e, được xếp theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự chu kì = số lớp e.
- Bảng tuần hoàn hiện có 7 chu kì được đánh số từ 1 đến 7:
-
- Chu kì 1, 2, 3: chu kì nhỏ.
- Chu kì 4, 5, 6, 7: chu kì lớn.
- Chu kì 7 chưa hoàn thành.
Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình e tương tự nhau do đó có tính chất hóa học gần giống nhau và được xếp thành 1 cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
-
- Nhóm A: bao gồm các nguyên tố s và p. Số thứ tự nhóm A = tổng số e lớp ngoài cùng
- Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng dạng (n – 1)dxnsy:
-
- Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
- Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
- Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
Khối nguyên tố (block)
- Các nguyên tố trong bảng tuần hoàn thuộc 4 khối: khối s, khối p, khối d và khối f.
- e cuối cùng điền vào phân lớp nào (theo thứ tự mức năng lượng) thì nguyên tố thuộc khối đó.
Đặc biệt nguyên tố H hiện nay được xếp ở hai vị trí là nhóm IA và VIIA đều ở chu kì I. Nguyên tố He mặc dù có 2e lớp ngoài cùng nhưng được xếp ở nhóm VIIIA. Điều này hoàn toàn phù hợp vì H giống kim loại kiềm đều có 1e ở lớp ngoài cùng nhưng nó cũng giống các halogen vì chỉ thiếu 1e nữa là đạt cấu hình bền giống khí hiếm He; còn He mặc dù có 2e ở lớp ngoài cùng nhưng giống các khí hiếm khác là cấu hình e đó là bão hòa.
Tham khảo: wikia.com
